|
Периодическое изменение свойств химических элементов и их соединений при увеличении заряда ядра атома объясняется тем, что периодически повторяется строение внешнего электронного слоя в атомах элементов. |
Ковалентная связь в химии: |
- Ковалентная связь: это химическая связь, обусловленная созданием общих электронных пар.
|
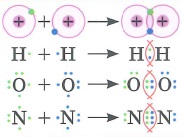 |
- Одинарная (двойная, тройная) ковалентная связь - это ковалентная связь, образованная одной (двумя, тремя соответственно) общими электронными парами.
|
|
При образовании общих электронных пар происходит перекрывание электронных орбиталей. |
- σ - связь образуется при перекрывании электронных орбиталей, идущих по линии, соединяющей центры атомов
|
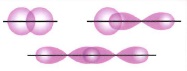 |
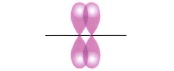
- π- связь образуется при перекрывании электронных орбиталей, вне линии, соединяющей центры атомов
|
 |
- Периодическое изменение свойств химических элементов и их соединений при увеличении заряда ядра атома объясняется тем, что периодически повторяется строение внешнего электронного слоя в атомах элементов.
|
- Валентность атома химического элемента в соединении с ковалентными связями равна числу общих электронных пар
|
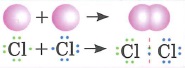
Ковалентная неполярная связь: |
|
|
 |
Ковалентная полярная связь: |
- Ковалентная полярная связь - это связь между атомами, электроотрицательность которых отличается незначительно
|
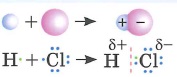 |
- Общие электронные пары смещены в сторону атома более электроотрицательного элемента
|
Характеристики ковалентной связи: |
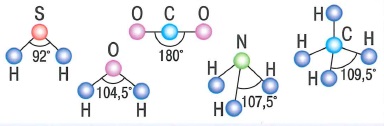
- Длина связи - это расстояние между ядрами связанных атомов
- Валентный угол - это угол между линиями, соединяющими химически связанные атомы.
|
Механизмы образования ковалентной связи: |
- Обменный механизм образования ковалентной связи: это когда при образовании общей электронной пары каждый из атомов предоставляет в совместное пользование по одному электрону
|
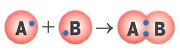 |
- Донорно-акцепторный механизм образования ковалентной связи: это когда при образовании общей электронной один из атомов (донор) дает в общее пользование электронную пару, а другой (акцептор) предоставляет свободную орбиталь
|
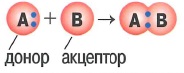 |
Ионная связь в химии: |
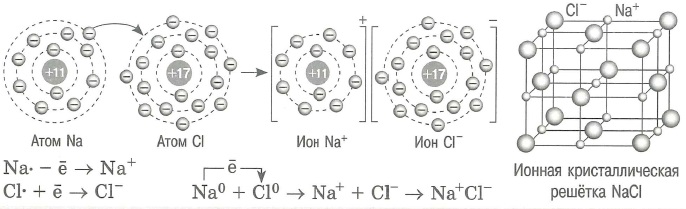
- Ионы: это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
- Катионы (+): это положительно заряженные ионы
- Анионы (-): это отрицательно заряженные ионы
|
- Ионная связь: это связь между катионом и анионом, обусловленная их электростатическим взаимодействием.
|
- Ионная связь возникает между атомами с резко отличающейся электроотрицательностью.
|
- Ионные соединения: это вещества, состоящие из ионов. Ионные соединения образованы типичными металлами и неметаллами.
|
Степень окисления. Окисление. Восстановление. Степень окисления : |
- Окисление: процесс отдачи частицей электронов
- Восстановление: процесс присоединения частицей электронов
- Степень окисления: заряд ионов в ионных соединениях или условный заряд на атомах в соединениях с ковалентной связью
|
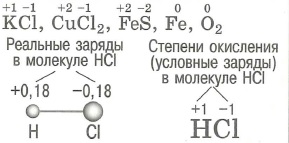 |
- Положительная степень окисления: равна числу электронов, отданных данным атомом
- Отрицательная степень окисления: равна числу электронов, принятых данным атомом
- Степень окисления в простом веществе равно 0.
- Сумма степеней окисления: всех атомов в соединении равна 0.
- Максимальная степень окисления элемента главной подгруппы в периодической системе равна номеру группы
- Минимальная степень окисления элемента главных подгрупп IV-VII групп равна = 8 минус (-) номер группы
|
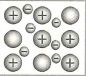
Металлическая связь в химии: |
- Металлическая связь: это связь в металлах и сплавах. Это связь между положительными ионами металла и свободными электронами (Mo-ne=Mn+).
- При этом электроны обобществляются и представляют собой так называемый "электронный газ".
|
|
|
|
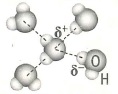
Водородная связь в химии: |
- Водородная связь: это форма ассоциации между электроотрицательным атомом и атомом водорода, связанным ковалентно с другим электроотрицательным атомом. Может быть внутримолекулярная водородная связь и межмолекулярная водородная связь.
|
 |

 главная страница / / Техническая информация / / Химический справочник / / Химия для самых маленьких. Шпаргалки. Детский сад, Школа. / / Виды химической связи. Ковалентная связь - полярная, неполярная. Характеристики, механизмы образования и виды ковалентной связи. Ионная связь. Степень окисления. Металлическая связь. Водородная связь.
главная страница / / Техническая информация / / Химический справочник / / Химия для самых маленьких. Шпаргалки. Детский сад, Школа. / / Виды химической связи. Ковалентная связь - полярная, неполярная. Характеристики, механизмы образования и виды ковалентной связи. Ионная связь. Степень окисления. Металлическая связь. Водородная связь.
 главная страница / / Техническая информация / / Химический справочник / / Химия для самых маленьких. Шпаргалки. Детский сад, Школа. / / Виды химической связи. Ковалентная связь - полярная, неполярная. Характеристики, механизмы образования и виды ковалентной связи. Ионная связь. Степень окисления. Металлическая связь. Водородная связь.
главная страница / / Техническая информация / / Химический справочник / / Химия для самых маленьких. Шпаргалки. Детский сад, Школа. / / Виды химической связи. Ковалентная связь - полярная, неполярная. Характеристики, механизмы образования и виды ковалентной связи. Ионная связь. Степень окисления. Металлическая связь. Водородная связь.

